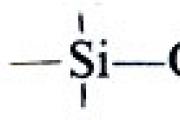Общие проблемы химии элементоорганических соединений. «Химия элементоорганических соединений
В истории развития органической химии имеется много примеров, когда некоторые разделы этой науки, не привлекавшие ранее большого внимания исследователей, начинали бурно развиваться благодаря неожиданному практическому применению того или иного класса соединений или выявлению их новых свойств.
Некоторые данные из истории элементоорганических соединений
Один из таких примеров связан с сульфамидами. Применение сульфамидных препаратов как ценных лечебных средств послужило началом интенсивного развития этой области органической химии - в короткий срок было синтезировано несколько тысяч новых сульфамидных препаратов.
Химия элементоорганических соединений находится сейчас в похожей стадии бурного развития. Это можно видеть из многих примеров. Химия фосфорорганических соединений, долгое время представлявших лишь теоретический интерес, в связи с начавшимся широким применением органических производных фосфора в разнообразных сферах народного хозяйства в настоящее время быстро развивается. Развитие химии органических соединений титана и алюминия было ускорено после открытия Циглером в 1954 г. способности алюминийорганических соединений в смеси с тетрахлоридом титана вызывать полимеризацию этилена, а также обнаружения Натта в 1955 г. возможности стереоспецифической полимеризации непредельных соединений в присутствии различных комплексных катализаторов.
Химия кремнийорганических соединений также развивается скачкообразно. Первое соединение, содержащее кремний и углерод, - этиловый эфир ортокремневой кислоты - было получено французским ученым Эбельменом в 1844 г. Позднее, в 1963 г., Фридель и Крафтс синтезировали первое кремнийорганическое соединение со связью Si-C - тетраэтилсилан. В начале развития химии кремнийорганических соединений, кремний, как ближайший аналог углерода, привлекал большое внимание исследователей. Казалось, что на основе кремния можно создать толь же широкую область химической науки, как органическая химия. Но, выяснилось, что кремний не образует подобно углероду стабильных цепей молекул из последовательно соединенных атомов Si, и поэтому интерес к органическим производным кремния сразу упал. Однако развитие химии высокомолекулярных соединений не могло ограничиться только использованием углерода и органогенных элементов (кислорода, галогенов, азота, серы) для построения молекул полимеров; оно, естественно, было устремлено к вовлечению других элементов Периодической системы. Это было продиктовано рядом соображений, по которым предполагалось, что замена углерода в основной цепи молекулы на другие элементы приведет к радикальному изменению свойств полимера.
Кремний был первым элементом, использованным К. А. Андриановым (1937 г.), а чуть позже М. М. Котоном (1939 г.) для построения неорганических главных цепей больших молекул, состоящих из чередующихся атомов кремния и кислорода и обрамленных органическими радикалами. Так появился новый класс кремнийорганических полимеров, известный теперь под названием полиорганосилоксанов, силоксанов или силиконов. Таким образом, советские исследователи впервые показали возможность применения кремнийорганических соединений (cиликонов) для синтеза полимеров с неорганическими цепями молекул и боковыми органическими группами. Этот этап стал поворотным в химии кремнийорганических полимеров и послужил началом интенсивных исследований не только кремнийорганических полимеров, но и других элементоорганических высокомолекулярных соединений,
В США первые сообщения по полиорганосилоксанам появились в 1941 г. (Ю. Рохов). В предисловии к русскому изданию миги Ю. Рохова, Д. Херда и Р. Льюиса "Химия металлоорганических соединений" (1963 г.) Ю. Рохов писал: "Как один из последователей фундаментальных работ К. А. Андрианова и Л. М. Котона в области химии кремний органических соединений, я полностью признаю успехи русских ученых в области синтеза и изучения металлоорганических соединений".
В последнее время к элементоорганическим полимерам проявляется большой интерес со стороны различных отраслей хозяйства, особенно машино- и аппаратостроения, авиации и ракетной техники; при этом самые высокие требования предъявляются к термической стабильности полимеров. Приведем в качестве примера энергетику. Расширение областей применения энергетических агрегатов требует увеличения масштабов производства электрооборудования и в связи с этим исключительно большого расхода меди, магнитных материалов и т. д. Кроме того, в связи с развитием авиации, флота и ракетной техники, а также электрификации подземных работ становится необходимым снижать массу и уменьшать габариты электрооборудования. Все это заставляет конструкторов создавать электротехнические устройства, имеющие большую мощность при малых массе и габаритах. При решении этих вопросов, естественно приходится повышать плотность тока, а это приводит к резкому росту рабочей температуры машины или аппарата. Поскольку полимеры являются важнейшими материалами для изготовления любых энергетических агрегатов, необходимо учитывать, что именно они как диэлектрики первыми воспринимают тепло, выделяемое токопроводящими элементами. И здесь становится особенно важной термическая стабильность полимерных материалов.
Внедрение атомной энергии в энергетику еще больше ужесточает требования, предъявляемые к диэлектрикам. В частности, в настоящее время нужны диэлектрики, способные длительно работать при 180-200°С, а при кратковременной работе выдерживать температуру 250-350°С и выше. Другой пример можно привести из современной авиации. Сейчас скорость самолетов увеличивается невероятно быстрыми темпами; при посадке таких скоростных самолетов в авиационных шинах развивается температура до 320°С и выше. Наряду с этим исключительно усложняется защита высокоскоростных самолетов от действия тепла, выделяемого при движении в атмосфере на большой скорости. Теплостойкие полимеры должны также помочь успешному решению задач освоения космического пространства.
Полиорганосилоксаны, как уже говорилось, были первыми представителями высокомолекулярных соединений с неорганическими главными цепями молекул, обрамленными органическими группами. Эти полимеры открыли ту новую область, которую химическая наука развивает без копирования природных веществ или материалов, так как полимеры такого состава неизвестны в природе и от начала до конца разработаны в лаборатории. Исследования элементоорганических высокомолекулярных соединений особенно расширились в послевоенный период, а сейчас их проводят во всех индустриальных и развивающихся странах. Число публикаций и патентов в этой области растет с каждым годом, причем непрерывно появляются новые работы теоретического и прикладного характера. Параллельно с этим бурно развивается промышленность элементоорганических полимеров и мономеров; мировое производство только кремнийорганических мономеров и полимеров к настоящему времени Достигло 1 млн. т в год.
В поле зрения исследователей, работающих над синтезом полимеров, находятся 45 элементов Периодической системы. Важнейшие элементы, привлекаемые для построения полимерных цепей, перечислены ниже:
- II группа Mg, Zn
- III группа B, Al
- IV группа C, Si, Ti, Ge, Zr, Sn, Pb
- V группа N, P, V, As, Sb, Bi
- VI группа O, S, Cr, Se, Mo
- VIII группа Fe, Co, Ni
Особенности химии в технологии элементоорганических соединений
Элементоорганические соединения по свойствам и строению значительно отличаются и от органических, и от неорганических соединений - они занимают промежуточное положение. Элементоорганические соединения в природе встречаются редко, их получают синтетическим путем.
В химии живых организмов роль элементоорганических соединений еще не совсем ясна, тем не менее можно с уверенностью сказать, что соединения кремния, фосфора и других элементов играют существенную роль в жизнедеятельности и метаболизме живых организмов, стоящих на высоком уровне эволюционного развития, в частности человека. В организме человека и животных кремнийсодержащие соединения присутствуют в различных формах, в том числе в виде кремнийорганических и комплексных соединений, растворимых в органических растворителях. Тем не менее для кремнийорганических соединений известен лишь один случай обнаружения их в природе - из перьев птиц выделен индивидуальный эфир ортокремневой кислоты состава Si(OC34H69)4- Большую роль в химии живых организмов играют фосфорорганические соединения, в первую очередь эфиры фосфорной и полифосфорной кислот. Так, аденозинтрифосфат (АТФ) содержится в живой ткани и играет жизненно важную роль в качестве источника энергии.
У элементоорганических соединений можно выделить несколько характерных особенностей, принципиально отличающих их от соединений углерода.
1. Различие в избирательном сродстве элементов по сравнению с углеродом.
Электроположительные элементы (Si, В, Al, Р) обладают значительно большим сродством к электроотрицательным элементам, чем углерод. Иначе говоря, кремний, бор, алюминий, фосфор и другие элементы образуют более слабые связи с электроположительными элементами (Н, Si, В, Al, As, Sb, Bi и др.), но более сильные - с электроотрицательными (О, N, Cl, Br, F и др.), чем углерод.
При рассмотрении электроотрицательности различных элементов видно, что углерод (хC = 2,5) занимает примерно среднее положение между самым электроотрицательным элементом - фтором (xF == 4,0) и самыми электроположительными элементами - цезием и францием (xCs = 0,7, хFr == 0,7). Полусумма электроотрицательностей этих элементов составляет хпс = 2,35 и, следовательно, атом С имеет наименьшую тенденцию отдавать или получать электроны, т. е. образовывать положительные или отрицательные ионы. А это значит, что углерод в соединениях менее ионизирован по сравнению с электроположительными или электроотрицательными элементами. Например, если связь Si-C1 ионизирована на 30-50%, то связь С-C1 - примерно на 6%. Поэтому углерод наименее подвержен электрофильной или нуклеофильной атаке, а значит, С-С-связь значительно более прочна, чем Э-Э-связь (например, В-В, Si-Si, A1-A1, Р-Р, As-As), и наоборот, например С-О-связь, полусумма электроотрицательности которой равна хпс = 3,0, менее прочна, чем связи А1-О (хпс = 2,5), Si-О (хпс = 2,65), Si-N (хпс = 2,4) и т. д. Сравнение энергии связей атомов бора, кремния., фосфора, мышьяка с энергией связи атомов углерода подтверждает эти положения (табл. 1).
Элементоорганические соединения - органические вещества, молекулы которых содержат химическую связь "элемент - углерод". К этой группе, как правило, не относят вещества, содержащие связи углерода с атомами азота, кислорода, серы и галогенов. Согласно такой классификации, одним из элементоорганических соединений считается, например, метилнатрий CH 3 Na, но к ним не относится метилат натрия CH 3 ONa, так как он не имеет связи элемент - углерод.
Элементоорганические соединения различаются как по химическим и физическим свойствам, так и по методам их получения. Большую группу представляют металлоорганические соединения. Первое из них - диэтилцинк (C 2 H 5) 2 Zn - было получено в 1849 г. Э. Франклендом. Соединения цинка широко применялись в синтезах А. М. Бутлеровым и другими учеными-химиками конца XIX в. Решающую роль в развитии химии элементоорганических соединений сыграло открытие магний- и ртутьорганических веществ. Они используются при синтезах многих элементоорганических и органических соединений.
Магнийорганические соединения были открыты в 1900 г. французским химиком Ф. Барбье и глубоко изучены его коллегой В. Гриньяром. Последний разработал метод их синтеза из галогеносодержащих углеводородов: RX + Mg → RMgX (R-углеводородный радикал, например СН 3 , С 2 Н 5 , С 6 Н 5 и др., а Х-атом галогена). В наше время реакции, подобные реакции Гриньяра, стали общим методом получения металлоорганических соединений (Li, Be, Mg, Са, Sr, Ва, А1 и Zn). Причем если атом металла не одновалентен, то он образует металлоорганические соединения, содержащие как органические радикалы, так и атомы галогенов: CH 3 MgCl, C 6 H 5 ZnBr, (С 2 Н 5) 2 АlСl.
Исследования в области ртутьорганических соединений, а также соединений свинца, олова и других металлов были начаты А. Н. Несмеяновым в 1922 г. Ртутьорганические соединения применяют для синтеза веществ, содержащих менее электроотрицательные элементы, стоящие в ряду напряжений до Hg (см. Ряд напряжений). Так получают очень активные соединения щелочных металлов и алюминия:
(C 2 H 5) 2 Hg + 2Na → 2C 2 H 5 Na + Hg
С помощью металлоорганических соединений получены различные производные углеводородов.
Многие металлоорганические соединения чрезвычайно легко реагируют с различными веществами. Так, метилнатрий и этилнатрий взрываются при соприкосновении с воздухом; самопроизвольно воспламеняются на воздухе органические соединения Be, Са, Ва, В, Al, Ga и др. Соединения Li, Mg и Be воспламеняются даже в атмосфере СO 2 .
Поскольку металлоорганические соединения очень легко окисляются, работа с ними требует специальной техники. Значительно устойчивее эфирные растворы магнийоргани-ческих веществ. Ими и пользуются обычно в лабораторной практике.
Химическая связь элемент - углерод в элементоорганических соединениях бывает как полярной (ионной), так и неполярной. Металлы, катионы которых имеют малый объем и большой заряд, образуют ко валентные связи; так возникают ртутьорганические соединения и соединения элементов IV и V групп. Металлы, легко отдающие электроны, т. е. имеющие большой объем и малый заряд ядра, например щелочные металлы, образуют ионные связи, в которых атом углерода С несет отрицательный заряд (М-атом металла). Наличие отрицательного заряда на атоме углерода таких соединений позволяет использовать их как катализаторы реакций полимеризации при получении синтетических каучуков. С помощью металлоорганических соединений алюминия и титана получают полиэтилен, полипропилен и другие полимеры.
В элементоорганических соединениях фосфора и мышьяка связи элемент - углерод поляризованы в обратном, по сравнению с другими металлоорганическими соединениями, направлении. Поэтому их химические свойства сильно отличаются от свойств иных веществ аналогичного состава. Родственный углероду элемент кремний образует с ним прочные малополярные связи. При этом возникает возможность использовать способность кремния заменять посредством химических реакций нестабильные (неустойчивые) связи на связи ![]() с образованием полимерных цепей. Кремнийорганические полимеры ценны тем, что сохраняют свои свойства как при высоких, так и при низких температурах, устойчивы к действию кислот и щелочей. Покрытия из таких полимеров надежно защищают материалы от разрушающего действия влаги. Эти соединения являются отличными электроизоляторами. Из линейных кремний-органических полимеров изготовляют смазки, гидравлические жидкости, выдерживающие и высокие, и низкие температуры, а также каучуки.
с образованием полимерных цепей. Кремнийорганические полимеры ценны тем, что сохраняют свои свойства как при высоких, так и при низких температурах, устойчивы к действию кислот и щелочей. Покрытия из таких полимеров надежно защищают материалы от разрушающего действия влаги. Эти соединения являются отличными электроизоляторами. Из линейных кремний-органических полимеров изготовляют смазки, гидравлические жидкости, выдерживающие и высокие, и низкие температуры, а также каучуки.
Элементоорганические соединения находят все большее применение в различных областях человеческой деятельности. Так, ртуть - и мышьякорганические вещества применяют в медицине и в сельском хозяйстве как бактерицидные, лекарственные и антисептические препараты; оловоорганические соединения - в качестве инсектицидов и гербицидов и т. д.
Элементоорганические соединения - органические вещества, молекулы которых содержат химическую связь «элемент - углерод». К этой группе, как правило, не относят вещества, содержащие связи углерода с атомами азота, кислорода, серы и галогенов. Согласно такой классификации, одним из элементоорганических соединений считается, например, метил‑натрий CH 3 Na, но к ним не относится метилат натрия CH 3 ONa, так как он не имеет связи "элемент - углерод".
Элементоорганические соединения различаются как по химическим и физическим свойствам, так и по методам их получения. Большую группу представляют металлоорганические соединения. Первые из них - диметилцинк (CH 3) 2 Zn, диэтилцинк (C 2 H 3) 2 Zn - были получены в 1849 г. английским химиком Э. Франклендом. Соединения цинка широко применялись в синтезах А. М. Бутлеровым и другими учеными-химиками конца XIX в. Решающую роль в развитии химии элементоорганических соединений сыграло открытие магний‑ и ртутьорганических веществ. Они используются при синтезах многих элементоорганических и органических соединений.
Магнийорганические соединения были открыты в 1899 г. французским химиком Ф. Барбье и глубоко изучены его коллегой В. Гриньяром. Последний разработал метод их синтеза из галогеносодержащих углеводородов: RX + Mg → RMgX (R - углеводородный радикал, например CH 3 , C 2 H 5 , C 6 H 5 и др., а X - атом галогена). В наше время реакции, подобные реакции Гриньяра, стали общим методом получения металлоорганических соединений (Li, Be, Mg, Ca, Sr, Ba, Al и Zn). Причем если атом металла не одновалентен, то он образует металлоорганические соединения, содержащие как органические радикалы, так и атомы галогенов: CH 3 MgCl, C 6 H 5 ZnBr, (C 2 H 5) 2 AlCl.
Исследования в области ртутьорганических соединений, а также соединений свинца, олова и других металлов были начаты А. Н. Несмеяновым в 1920‑х гг. Ртутьорганические соединения применяют для синтеза веществ, содержащих менее электроотрицательные элементы, стоящие в ряду напряжений до Hg (см. Ряд напряжений). Так получают очень активные соединения щелочных металлов и алюминия
(C 2 H 5) 2 Hg + 2 Na → 2C 2 H 5 Na + Hg
С помощью металлоорганических соединений получены различные производные углеводородов.
Многие металлоорганические соединения чрезвычайно легко реагируют с различными веществами. Так, метилнатрий и этилнатрий взрываются при соприкосновении с воздухом; самопроизвольно воспламеняются на воздухе органические соединения Be, Ca, Ba, B, Al, Ga и др.
Соединения Li, Mg и Be воспламеняются даже в атмосфере CO 2 .
Поскольку металлоорганические соединения очень легко окисляются, работа с ними требует специальной техники. Значительно устойчивее эфирные растворы магнийорганических веществ. Ими и пользуются обычно в лабораторной практике.
Химическая связь «элемент - углерод» в элементоорганических соединениях бывает как полярной (ионной), так и неполярной. Металлы, катионы которых имеют малый объем и большой заряд, образуют ковалентные связи; так возникают ртутьорганические соединения и соединения элементов IV и V групп. Металлы, легко отдающие электроны, т. е. имеющие большой объем и малый заряд ядра, например щелочные металлы, образуют ионные связи, в которых атом углерода C несет отрицательный заряд −>C − M + (M - атом металла). Наличие отрицательного заряда на атоме углерода таких соединений позволяет использовать их как катализаторы реакций полимеризации при получении синтетических каучуков. С помощью металлоорганических соединений алюминия и титана получают полиэтилен, полипропилен и другие полимеры.
В элементоорганических соединениях фосфора и мышьяка связи элемент - углерод поляризованы в обратном, по сравнению с другими металлоорганическими соединениями, направлении. Поэтому их химические свойства сильно отличаются от свойств иных веществ аналогичного состава. Родственный углероду элемент кремний образует с ним прочные малополярные связи. При этом возникает возможность использовать способность кремния заменять посредством химических реакций нестабильные (неустойчивые) связи −>Si−Cl, −>Si−H и −>Si−OH на связи −>Si−O−Si<− с образованием полимерных цепей. Кремнийорганические полимеры ценны тем, что сохраняют свои свойства как при высоких, так и при низких температурах, устойчивы к действию кислот и щелочей. Покрытия из таких полимеров надежно защищают материалы от разрушающего действия влаги. Эти соединения являются отличными электроизоляторами. Из линейных кремнийорганических полимеров изготовляют смазки, гидравлические жидкости, выдерживающие и высокие, и низкие температуры, а также каучуки.
Элементоорганические соединения находят все большее применение в различных областях человеческой деятельности. Так, ртуть‑ и мышьякорганические вещества применяют в медицине и в сельском хозяйстве как бактерицидные, лекарственные и антисептические препараты; оловоорганические соединения - в качестве инсектицидов и гербицидов и т. д.
ПРОГРАММА-МИНИМУМ
кандидатского экзамена по специальности
02.00.08 «Химия элементоорганических соединений»
по химическим и техническим наукам
Введение
В основу настоящей программы положены следующие дисциплины: теоретические представления о природе химических связей и электронном строении элементоорганических соединений (ЭОС), физические методы исследования структуры и электронного строения ЭОС, органические производные непереходных элементов, органические производные переходных металлов.
Программа разработана экспертным советом Высшей аттестационной комиссии Министерства образования Российской Федерации по химии (по органической химии) при участии Института элементоорганических соединений им. РАН.
1.Теоретические представления о природе химических связей и электронном строении элементоорганических соединений
Классификация элементоорганических соединений (ЭОС). Основные этапы развития химии ЭОС. Ее влияние на теорию химического строения молекулярных систем.
Основные положения квантовой химии. Уравнение Шредингера для атомно-молекулярной системы как основа для теоретического исследования ее структуры и электронного строения. Электронное строение атомов и их ионов. Атомные орбитали и их классификация.
Теоретические методы моделирования структуры и электронного строения молекул. Адиабатическое приближение. Понятие о поверхности потенциальной энергии молекулы. Метод молекулярных орбиталей (МО) как основа современной квантовой химии. Основные принципы построения неэмпирических и полуэмпирических квантово-химических методов. Использование методов квантовой химии для расчетов наблюдаемых свойств молекул. Анализ электронного строения молекул в терминах эффективных зарядов на атомах и заселенностей (порядков) связей.
Сопряженные молекулы как лиганды в ЭОС. Электронное строение сопряженных молекул в?-электронном приближении. Метод Хюккеля. Схемы?-электронных уровней энергий и?-МО аллила, бутадиена, аниона циклопентадиенила, бензола, циклооктатетраена.
Концепция ароматичности в химии ЭОС. Примеры металлорганических ароматических систем.
Природа химических связей в ЭОС. Гибридные орбитали и принципы их использования в качественной теории химического строения. Классификация типов химических связей в ЭОС. Природа связи в олефиновых, ацетиленовых, циклопентадиенильных и ареновых комплексах переходных металлов. Кратные связи элемент-углерод и элемент-элемент. Многоцентровые связи.
Симметрия молекул и ее использование в теории химического строения ЭОС.
Молекулярные орбитали в олефиновых, аллильных, циклопентадиенильных и ареновых комплексах. Химические связи в электронодефицитных молекулах (на примерах простейших и полиэдрических гидридов бора и карборанов).
Качественные способы оценки стабильности ЭОС. Правило эффективного атомного номера. Принцип изолобальной аналогии и его приложения.
Теоретические основы стереохимии ЭОС. Понятие о конформациях и конфигурациях. Координационные полиэдры, характерные для координационных чисел 4, 5, 6. Хиральность полиэдров с моно - и бидентатными лигандами. Планарная хиральность и оптическая активность металлокомплексов с?-олефиновыми, ?-циклопентадиенильными, ?-ареновыми лигандами.
2. Реакционная способность элементоорганических соединений
Основные типы реагентов (электрофилы, нуклеофилы, протофилы, радикофилы, карбеноиды). Классификация основных типов реакций с участием ЭОС. Реакции по связи металл-лиганд (реакции замещения, присоединения, элиминирования, фрагментации, внедрения, окислительного присоединения, восстановительного элиминирования). Превращения лигандов в координационной сфере металлов (структурно нежесткие соединения, внутримолекулярные перегруппировки и молекулярная динамика ЭОС (таутомерия, металлотропия, внутренние вращения вокруг связи металл-лиганд). Окислительно-восстановительные превращения металлорганических соединений.
Различия в строении и свойствах ЭОС в газовой, жидкой и твердой фазах. Роль полярности среды и специфической сольватации. Ионы и ионные пары, их реакционная способность.
Равновесная СН-кислотность, шкалы СН-кислотности, влияние строения СН-кислот на равновесную СН-кислотность, кинетическая кислотность СН-кислот.
3. Физические методы исследования структуры
и электронного строения ЭОС
ЯМР-спектроскопии (импульсная ЯМР-фурье спектроскопия, динамический ЯМР) в исследовании строения и реакционной способности ЭОС. Физические и теоретические основы метода. Понятие об основных ЯМР-параметрах: химическом сдвиге, константах спин-спинового взаимодействия, временах релаксации. Области применения в химии ЭОС: изучение строения и динамики молекул, определение примесей.
Масс-спектрометрия. Физические и теоретические основы метода. Области применения в химии ЭОС: установление состава и строения молекул, качественный и количественный анализ смесей (хромато-масс-спектрометрия), определение микропримесей, изотопный анализ, измерение термохимических параметров (энергии ионизации молекул, энергии появления ионов, энергии диссоциации связей), изучение ионно-молекулярных реакций, газофазная кислотность и основность молекул.
Метод рентгеноструктурного анализа (РСА). Физические и теоретические основы метода. Области применения в химии ЭОС: установление строения молекул и кристаллов, исследование природы химических связей.
Фото - (ФЭС) и рентгенофотоэлектронная (ЭСХА) спектроскопии. Физические и теоретические основы методов. Применение в химии ЭОС: изучение электронного строения молекул, измерение энергий ионизации.
Оптическая спектроскопия (ИК, УФ, КР). Физические и теоретические основы методов. Применение в химии ЭОС: установление строения молекул, изучение динамики молекул, измерение концентрации. Применение симметрии при интерпретации экспериментальных спектров.
Спектроскопия электронного парамагнитного резонанса (ЭПР). Физические и теоретические основы методов. Применение в химии ЭОС: установление строения радикалов, изучение динамики молекул и механизмов радикальных реакций.
4. Органические производные непереходных элементов
Органические производные щелочных металлов (I группа).
Литийорганические соединения, их свойства, строение, методы получения и применение в органическом синтезе.
Органические соединения натрия и калия.
Реакции металлирования. Ароматические анион-радикалы: образование, строение, свойства.
Органические производные элементов II группы.
Магнийорганические соединения: получение, строение, свойства. Роль растворителя в синтезе магнийорганических соединений. Реакционная способность магнийорганических соединений и их применение в органическом и металлорганическом синтезе.
Органические производные элементов XII группы.
Цинк - и кадмийорганические соединения: получение, строение, свойства. Реакция Реформатского.
Органические соединения ртути: получение, строение, свойства. Меркурирование ароматических соединений. Реакция Несмеянова.
Симметризация и диспропорционирование ртутьорганических соединений. Ртутьорганические соединения в синтезе органических производных других металлов и органическом синтезе.
Органические соединения элементов III группы.
Борорганические соединения. Основные типы соединений, синтез, свойства, реакции. Гидроборирование ненасыщенных соединений, региоселективность реакции. Применение борорганических соединений в органическом синтезе.
Карбораны, металлокарбораны, получение, свойства. Основные типы карборанов. Икосаэдрические карбораны, основные реакции.
Алюминийорганические соединения. Основные типы соединений, синтез, свойства, реакции. Катализаторы Циглера-Натта. Применение алюминийорганических соединений в промышленности и органическом синтезе.
Органические соединения элементов XIII группы.
Галлий-, индий - и таллийорганические соединения: получение, строение, свойства.
Применение таллийорганических соединений в органическом синтезе.
Получение полупроводниковых материалов методом газофазного разложения галлий - и индийорганических соединений.
Сравнительная реакционная способность органических производных элементов XIII группы.
Органические соединения элементов XIV группы.
Кремнийорганические соединения: получение, строение, свойства.
Гидросилилирование ненасыщенных производных. Полиорганосилоксаны. Силиловые эфиры. Кремнийорганические соединения в органическом синтезе и промышленности.
Германий-, олово- и свинецорганические соединения. Основные типы соединений, получение, строение, свойства и реакции. Представление о гипервалентных соединениях.
Практическое использование органических производных элементов XIV группы.
Соединения элементов XIV группы с - связью элемент-элемент: синтез, строение, свойства.
Соединения элементов XIV группы с кратными связями элемент-элемент: синтез, строение, свойства. Проблема двоесвязанности в химии ЭОС непереходных элементов.
Органические производные элементов XV группы.
Органические производные фосфора и мышьяка, основные типы соединений высшей и низшей степеней окисления, методы синтеза, строение, свойства. Гетероциклические соединения фосфора. Реакция Виттига. Применение органических производных элементов V группы в промышленности, сельском хозяйстве , медицине.
Сурьма - и висмуторганические соединения.
5. Органические производные переходных металлов
Классификация металлорганических соединений переходных металлов по типу лигандов, координированных с металлом.
Карбонильные комплексы переходных металлов.
Основные типы карбонилов металлов. Методы синтеза, строение и реакции. Карбонилат анионы, карбонил галогениды, карбонилгидриды. Природа связи металл-карбонил.
Металлкарбонильные кластеры переходных металлов. Основные типы, получение. Стереохимическая нежесткость: миграция карбонильных, гидридных, углеводородных лигандов и металлического остова. Превращения углеводородов на кластерных карбонилах металлов.
Практическое применение карбонилов металлов.
Соединения с?-связью металл-углерод
Основные типы?-органических производных переходных металлов: синтез, строение, свойства. Факторы, влияющие на их устойчивость. Роль стабилизирующих n - и?-лигандов. - ацетиленовые производные переходных металлов.
Реакции?-производных: расщепление?-связи М-С, внедрение ненасыщенных молекул, восстановительное элиминирование, ?-перегруппировки.
Гидридные комплексы переходных металлов.
Основные типы водородных комплексов переходных металлов. Соединения с водородным атомом: моно-, би - и полиядерные. Соединения с терминальным и мостиковым атомами водорода. Соединения с молекулярным водородом: синтез, строение, свойства. Характер связи металл-водород, ее полярность, возможность диссоциации. Взаимные превращения водородных комплексов и?-органических соединений переходных металлов. Роль водородных комплексов в металлорганическом синтезе и катализе.
Карбеновые и карбиновые комплексы переходных металлов.
Карбеновые комплексы переходных металлов. Электронное строение. ?, ?-синергизм. Карбеновые комплексы Фишера. Карбеновые комплексы Шрока. Методы синтеза карбеновых комплексов Фишера (по Фишеру, по Лэпперту, из диазоалканов и?-комплексов переходных металлов.
Реакции карбеновых комплексов Фишера (нуклеофильное присоединение к С(?), депротонирование связей С(?)-Н. Роль карбеновых комплексов в катализе (метатезис олефинов). Использование в тонком органическом синтезе. Реакция Дeтца. Метатезис циклических алкенов.
Карбиновые комплексы переходных металлов. Электронное строение. Карбиновые комплексы Фишера. Карбиновые комплексы Шрока. Синтез карбиновых комплексов действием кислот Льюиса на карбеновые комплексы Фишера. Реакции карбиновых комплексов с нуклеофильными реагентами. Роль карбиновых комплексов в катализе: метатезис и полимеризация алкинов.
?-комплексы переходных металлов
Общая характеристика строения и устойчивости. Различные типы связей металл-лиганд. Структурно нежесткие соединения. Внутренняя динамика молекул.
?-комплексы металлов с олефинами
Типы комплексов с линейными и циклическими моно - и полиолефинами. Методы получения, строение, свойства. Природа связи олефина с металлом. Реакции?-координированных лигандов. Циклобутадиенжелезотрикарбонил. Роль олефиновых комплексов в катализе.
?-ацетиленовые комплексы
Типы ацетиленовых комплексов. Методы получения, строение, свойства. Моно - и биметаллические комплексы. Ацетилен-винилиденовая перегруппиовка в координационной сфере металлов как метод синтеза винилиденовых комплексов. Ацетиленовые комплексы в катализе.
Аллильные комплексы
Типы аллильных комплексов. Методы синтеза, строение, реакции. Роль в катализе.
Циклопентадиенильные комплексы
Типы комплексов. Строение.
Металлоцены: ферроцен, никелецен, кобальтоцен. Синтез. Реакционная способность (замещение в лиганде, реакции с разрывом связи металл-кольцо, редокс-реакции). Металлоценилалкильные катионы.
Циклопентадиенильные производные титана и циркония. Типы комплексов. Синтез, применение в катализе процессов полимеризации.
Циклопентадиенилкарбонильные комплексы. Синтез. Химия циклопентадиенилмарганецтрикарбонила (цимантрена).
Циклопентадиенилкарбонильные комплексы железа, кобальта, молибдена.
Ареновые комплексы
Типы ареновых комплексов.
Бис-ареновые комплексы хрома. Методы получения и реакции.
Аренхромтрикарбонильные комплексы. Методы получения и реакции. Применение в органическом синтезе.
Катионные ареновые комплексы железа и марганца. Синтез и реакции.
Би - и полиядерные соединения переходных металлов.
Линейные би - и полиядерные соединения переходных металлов: синтез, строение, свойства. Природа связи маталл-лиганд. Соединения с кратными связями металл-металл.
Кластерные (каркасные) соединения переходных металлов. Важнейшие структурные типы кластеров, их минимальные и максимальные размеры. Электронное строение. Свойства и динамика молекул.
Каталитические процессы с участием металлорганических соединений переходных металлов
Олигомеризация олефинов и ацетиленов. Никелевые комплексы в катализе олигомеризации этилена. Циклоолигомеризация (системы, содержащие никель (0)) и линейная олигомеризация бутадиена (системы, содержащие палладий (0)). Циклическая тримеризация и тетрамеризация ацетиленов (синтез производных бензола и циклооктатетраена).
Полимеризация олефинов: катализаторы Циглера-Натта, полиэтилен, полипропилен. Стереоспецифическая полимеризация бутадиена.
Изомеризация олефинов: миграция двойной связи с участием металлалкильных и металлаллильных интермедиатов. Реакция метатезиса олефинов.
Гомогенное гидрирование: комплексы с молекулярным водородом, механизмы активации водорода, родиевые, кобальтовые и рутениевые катализаторы. Селективное гидрирование. Асимметрическое гидрирование.
Каталитические превращения моноуглеродных молекул; оксо-синтез: кобальтовые и родиевые катализаторы. Синтез Фишера-Тропша. Конверсия водяного газа. Карбонилирование и гидрокарбонилирование.
Окисление олефинов: эпоксидирование, катализируемое переходными металлами. Получение ацетальдегида и винилацетата из этилена.
Аллильное алкилирование СН - , NH - и ОН - органических соединений в условиях металлокомплексного катализа. Моно - , ди - и полидентатные лиганды. Хиральные лиганды и асимметрический синтез.
Метатезис олефинов и ацетиленов. Реакция кросс-сочетания.
Основные представления биометаллорганической химии
Понятие о металлоферментах: хлорофилл, цитохромы, ферредоксины, витамин В12, строение и биологические функции. Применение металлорганических соединений в медицине.
Органические соединения f-элементов
Представления об органических соединениях f -элементов. Важнейшие структурные типы, методы синтеза, природа связи, динамика молекул.
Основная литература
1. Методы элементоорганической химии / Под ред. и. М.: Наука, 1973.
2. Коттон Ф., Уилкинсон Дж. Основы неорганической химии . Гл. 28-31. М.: Мир, 1979.
3. Грин М. Металлорганические соединения переходных металлов. М.: Мир, 1972.
4. , Шульпин комплексов со связями металл-углерод. Новосибирск: Наука, 1984.
5. Общая органическая химия. М. Т.4,5. 1983; Т.6,7. 1984.
6. Органикум, Т. 1, 2. М.: Мир, 1992.
Дополнительная литература к разделу 1
1. Хьюи Ж. Неорганическая химия. Строение вещества и реакционная способность. М.: Химия, 1987.
2. , Миняев строения молекул. М.: Высш. шк., 1979.
3. , Станкевич концепции химической связи от водорода до кластерных соединений // Успехи химии. 1989. Т.58.
4. Соколов основы стереохимии. М.: Наука, 1979.
Дополнительная литература к разделу 2
1. , Реутов О. А, Соколов реакций металлорганических соединений. М.: Химия, 1972.
2. , СН-кислотность. М.: Наука, 1980.
Дополнительная литература к разделу 3
1. Драго Р. Физические методы в химии. Т.1,2. М.: Мир, 1981.
2. Гюнтер Х. Введение в курс спектроскопии ЯМР. М.: Мир, 1984.
3. Некрасов аспекты масс-спектрометрического анализа органических веществ // ЖАХ, 1991. Т.46, N 9.
4. Шашков А. Спектроскопия ЯМР // Органическая химия. Гл. 5. М.: Химия, 2000.
Дополнительная литература к разделу 4
1. Михайлов. Химия бороводородов. М.: Наука, 1967.
2. Пурдела Д., Вылчану Р. Химия органических соединений фосфора. М.: Химия, 1972.
3. Граймс. М.: Мир, 1974.
Дополнительная литература к разделу 5
1. Хеирици-Оливэ Г., Оливэ С. Координация и катализ. М.: Мир,1980.
2. Калинин химии. 1987. Т. 46.
3. Шульпин реакции, катализируемые комплексами металлов. М.: Наука, 1988.
4. Металло-органическая химия переходных металлов / Дж. Колмен, Л. Хегедас, Дж. Нортон, Р. Финке. М.: Мир, 1989.
5. Коридзе производные кластерных карбонилов переходных металлов // Изв. РАН. Сер. хим. 2000. №7.
6. Хеирици-Оливэ Г., Оливэ С. Химия каталитического гидрирования СО. М.: Мир,1987.
7. Яцимирский в бионеорганическую химию. Киев: Наукова думка, 1976.
8. Хьюз М. Неорганическая химия биологических процессов. М.: Мир, 1983.
Элементоорганические соединения - органические вещества, молекулы которых содержат химическую связь «элемент - углерод». К этой группе, как правило, не относят вещества, содержащие связи углерода с атомами азота, кислорода, серы и галогенов. Согласно такой классификации, одним из элементоорганических соединений считается, например, метил-натрий , но к ним не относится метилат натрия , так как он не имеет связи "элемент-углерод".
Элементоорганические соединения различаются как по химическим и физическим свойствам, так и по методам их получения. Большую группу представляют металлоорганические соединения.
Первые из них - диметилцинк , диэтилцинк - были получены в 1849 г. английским химиком Э. Франклендом. Соединения цинка широко применялись в синтезах А. М. Бутлеровым и другими учеными-химиками конца XIX в. Решающую роль в развитии химии элементоорганических соединений сыграло открытие магний- и ртутьорганических веществ. Они используются при синтезах многих элементоорганических и органических соединений.
Магнийорганические соединения были открыты в 1899 г. французским химиком Ф. Барбье и глубоко изучены его коллегой В. Гриньяром. Последний разработал метод их синтеза из галогеносодержащих углеводородов: - углеводородный радикал, например и др., а X - атом галогена). В наше время реакции, подобные реакции Гриньяра, стали общим методом получения металлоорганических соединений и . Причем если атом металла не одновалентен, то он образует металлоорганические соединения, содержащие как органические радикалы, так и атомы галогенов: .
Исследования в области ртутьорганических соединений, а также соединений свинца, олова и других металлов были начаты А. Н. Несмеяновым в 1920-х гг. Ртутьорганические соединения применяют для синтеза веществ, содержащих менее электроотрицательные элементы, стоящие в ряду напряжений до (см. Ряд напряжений). Так получают очень активные соединения щелочных металлов и алюминия
С помощью металлоорганических соединений получены различные производные углеводородов.
Многие металлоорганические соединения чрезвычайно легко реагируют с различными веществами. Так, метилнатрий и этилнатрий взрываются при соприкосновении с воздухом; самопроизвольно воспламеняются на воздухе органические соединения , В, и др.
Соединения и воспламеняются даже в атмосфере .
Поскольку металлоорганические соединения очень легко окисляются, работа с ними требует специальной техники. Значительно устойчивее эфирные растворы магнийорганических веществ. Ими и пользуются обычно в лабораторной практике.
Химическая связь «элемент - углерод» в элементоорганических соединениях бывает как полярной (ионной), так и неполярной. Металлы, катионы которых имеют малый объем и большой заряд, образуют ковалентные связи; так возникают ртутьорганические соединения и соединения элементов IV и V групп. Металлы, легко отдающие электроны, т. е. имеющие большой объем и малый заряд ядра, например щелочные металлы, образуют ионные связи, в которых атом углерода С несет отрицательный заряд (М - атом металла). Наличие отрицательного заряда на атоме углерода таких соединений позволяет использовать их как катализаторы реакций полимеризации при получении синтетических каучуков. С помощью металлоорганических соединений алюминия и титана получают полиэтилен, полипропилен и другие полимеры.
В элементоорганических соединениях фосфора и мышьяка связи элемент - углерод поляризованы в обратном, по сравнению с другими металлоорганическими соединениями, направлении. Поэтому их химические свойства сильно отличаются от свойств иных веществ аналогичного состава. Родственный углероду элемент кремний образует с ним прочные малополярные связи. При этом возникает возможность использовать способность кремния заменять посредством химических реакций нестабильные (неустойчивые) связи и на связи с образованием полимерных цепей. Кремнийорганические полимеры ценны тем, что сохраняют свои свойства как при высоких, так и при низких температурах, устойчивы к действию кислот и щелочей. Покрытия из таких полимеров надежно защищают материалы от разрушающего действия влаги. Эти соединения являются отличными электроизоляторами. Из линейных кремнийорганических полимеров изготовляют смазки, гидравлические жидкости, выдерживающие и высокие, и низкие температуры, а также каучуки.
Элементоорганические соединения находят все большее применение в различных областях человеческой деятельности. Так, ртуть- и мышьякоргани-ческие вещества применяют в медицине и в сельском хозяйстве как бактерицидные, лекарственные и антисептические препараты; оловоорганические соединения - в качестве инсектицидов и гербицидов и т. д.